卵巢癌是女性生殖系统常见的恶性肿瘤之一。其年发病率居女性生殖系统肿瘤第三位,而患者死亡率更是居于首位,严重威胁女性生命健康。数十年来,以化疗为“基石”的卵巢癌治疗模式,虽在一定程度上改善了患者预后,但卵巢癌患者的三个“70%”仍如同魔咒,挥之不去。70%卵巢癌患者就诊时已为晚期,70%的卵巢癌患者初始治疗后三年内复发[1, 2]。70%的晚期卵巢癌患者生存时间不超过5年[2]。因此,如何打破卵巢癌患者“手术+化疗,短期复发再化疗”的恶性循环,成为学界研究的焦点。
2018及2019年欧洲肿瘤内科学会(ESMO)年会上公布了多项针对于新诊断晚期卵巢癌患者一线维持治疗相关研究无进展生存(PFS)数据(SOLO-1研究、PAOLA-1研究、PRIMA研究)。聚腺苷二磷酸核糖聚合酶(PARP)抑制剂正是凭借在上述研究中展现出的优秀疗效与良好安全性,成功将晚期卵巢癌患者带入了“手术+化疗+维持治疗”的“新模式”。自此,PARP抑制剂也成功改写了晚期卵巢癌患者的治疗格局。
手术:新诊断卵巢癌患者的“基石”治疗
·
全面分期手术:适用于临床早期卵巢癌恶性肿瘤患者,腹腔镜手术仅适用于肿瘤体积小,可以完整装入取物袋中取出的病例,目的在于切除肿瘤,全面手术病理分期。
·
·
肿瘤细胞减灭手术:适用于临床拟诊断为中晚期(部分Ⅱ期、Ⅲ期和Ⅳ期)的卵巢恶性肿瘤患者,目的在于最大程度切除所有肉眼可见的肿瘤,降低肿瘤负荷,提高化疗疗效,改善预后[3]。
·
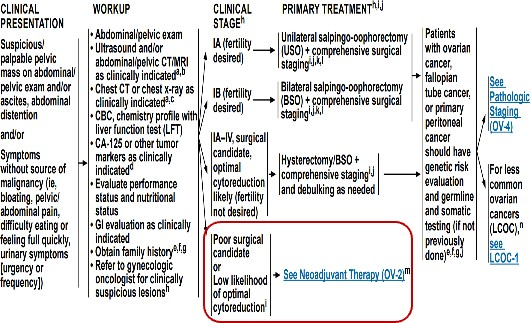
图1:美国国家综合癌症网络(NCCN) 2022 V5 新诊断卵巢癌患者的手术原则[3]
一线治疗:化疗+贝伐珠单抗,显著提升PFS
在卵巢癌患者的一线治疗方面,NCCN 2022 卵巢癌诊疗指南推荐:
·
早期的新诊断卵巢癌患者:一线治疗首选方案是卡铂+紫杉醇联合化疗。
·
·
中晚期新诊断卵巢癌患者:一线治疗首选方案是卡铂+紫杉醇+贝伐珠单抗三联药物治疗[3]。
·
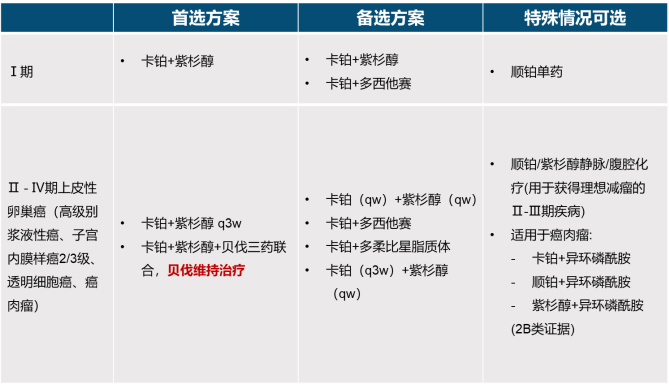
图2:NCCN 2022 V5 新诊断卵巢癌患者一线治疗方案[3]
而对于新诊断卵巢癌患者,加入贝伐珠单抗联合治疗的获益及临床应用价值如何。两项用于探索卵巢癌初始化疗+贝伐珠单抗治疗,并在化疗结束后序贯贝伐珠单抗维持治疗有效性和安全性的随机对照临床研究(ICON7研究、GOG0218研究)给出了答案。
上述两个研究显示,一线含铂化疗联合贝伐珠单抗方案,可以显著改善卵巢癌患者的无进展生存(PFS),提高疾病患者率并增加PARP抑制剂一线维持治疗使用人群。与此同时,上述联合方案还能够提高铂敏感复发比例,增加PARP抑制剂在铂敏感复发患者维持治疗中的使用。ICON7研究显示,相比于联合化疗,加入联合贝伐珠单抗的治疗方案可显著提升卵巢癌患者19%的客观缓解率(ORR)[4, 5]。
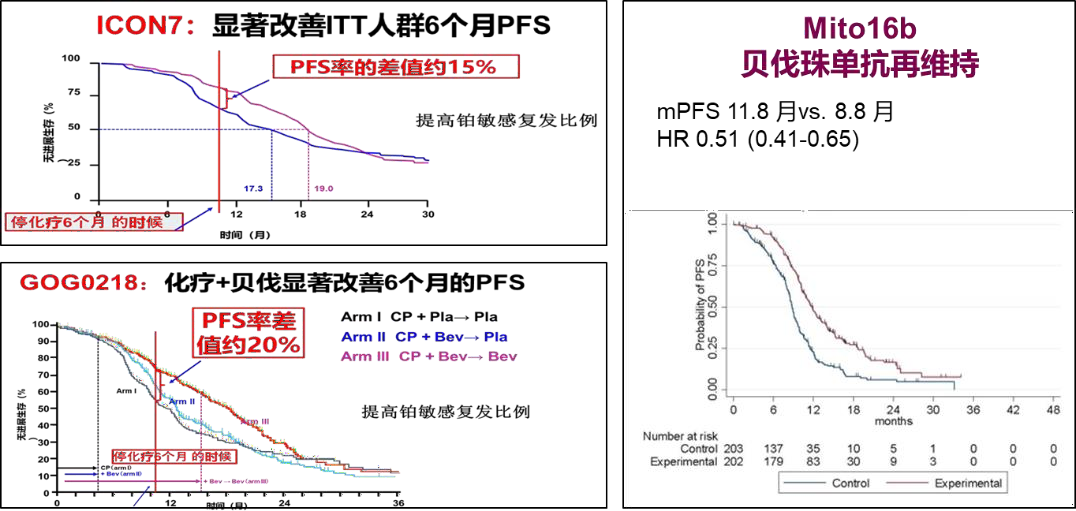
图3:ICON7、GOG0218和Mito16b研究*的PFS结果[4-6]
*研究用药均为原研贝伐珠单抗
对于经贝伐珠单抗联合治疗后复发患者,Mito16b研究也再次证实:在一线治疗方案中联合使用贝伐珠单抗,并不影响患者复发时再次应用贝伐珠单抗治疗[6]。
一线维持:精准靶向,PARP抑制剂精准维持进入“超长OS”时代
·
2018-2019年ESMO年会:SOLO-1研究、PAOLA-1研究、PRIMA研究主要终点PFS结果的公布,成功推动了奥拉帕利获批卵巢癌一线维持治疗,也彻底改变了晚期卵巢癌患者的治疗格局。
·
·
2020年ESMO年会:SOLO-1研究5年随访数据公布,创下了PARP抑制剂卵巢癌一线维持治疗“最长PFS”纪录,让携带乳腺癌易感基因突变(BRCAm)卵巢癌患者看到了“临床治愈”的希望。
·
·
2022年ESMO年会:SOLO-1研究7年超长随访数据得以公布,在长达7年的随访后,奥拉帕利治疗组患者总生存(OS)仍未达到,较安慰剂组的75.2个月展现出临床优势。
·
·
2022年美国妇科肿瘤学会(SGO)年会:PRIME研究生存数据得以公布。与安慰剂相比,接受尼拉帕利治疗显著延长了患者的PFS,[24.8个月对比8.3个月(PFS HR 0.45;p<0.001)]
·
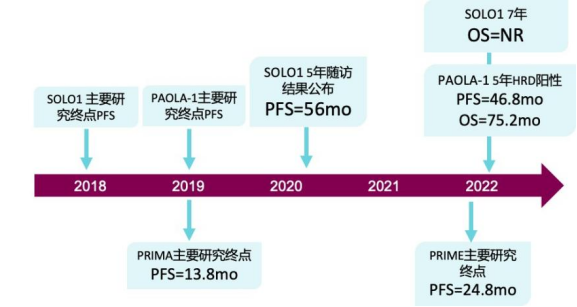
图4:PARP抑制剂一线维持治疗相关研究进展[7-13]
上述研究重磅数据的公布,在晚期卵巢癌一线治疗领域具有里程碑的意义。毫无疑问,PARP抑制剂维持治疗十分显著的改善了上述患者的生存获益,可谓意义重大。而临床实践中,是否所有晚期卵巢癌患者均能够从PARP抑制剂一线维持治疗中获益?一线维持治疗方案又该如何进行抉择,又成为了临床医生拥有多个药物选择后“幸福的烦恼”。
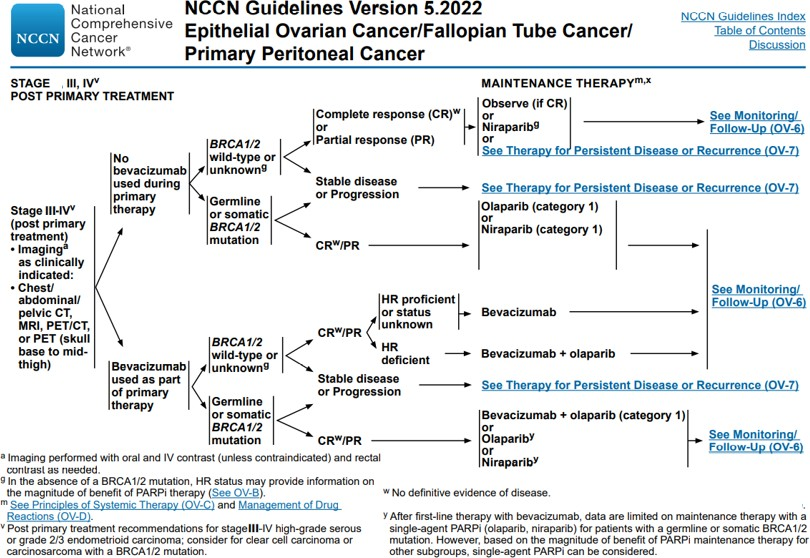
图5:NCCN 2022 V5 一线PARP抑制剂维持治疗方案[3]
根据NCCN 2022 V5版卵巢癌诊疗指南推荐,根据基因结果靶向选择一线PARP抑制剂维持治疗方案,是一种科学有效的决策手段。
NCCN 指南推荐:
▌对于初始治疗未联合贝伐珠单抗的晚期卵巢癌患者:
·
携带BRCA1/2胚系或体系突变:选择奥拉帕利或尼拉帕利维持治疗。
·
·
未见BRCA1/2突变或未确定:选择尼拉帕利维持治疗。
·
▌对于初始治疗已联合贝伐珠单抗的晚期卵巢癌患者:
·
携带BRCA1/2胚系或体系突变:选择贝伐珠单抗+奥拉帕利/奥拉帕利/尼拉帕利单药维持治疗。
·
在一线维持治疗方案选择上,对于未见BRCA1/2突变患者,HRD状态是判断 PARP抑制剂是否获益的重要指标。BRCA1/2是重要的抑癌基因。相关研究证实,携带BRCA1/2突变的多种肿瘤对PARP抑制剂敏感。因而,BRCA突变状态对于卵巢癌患者一线维持治疗选择及预后改善至关重要。报告介绍了不同BRCA突变状态患者,在PARP抑制剂维持治疗中的获益情况。
在SOLO-1研究中,携带胚系或体细胞BRCA1/2突变的晚期上皮性卵巢癌患者在初始治疗缓解后,应用奥拉帕利一线维持治疗,患者7年OS率提升20.5%。相比于安慰剂,降低死亡风险45%,中位PFS延长3年以上。
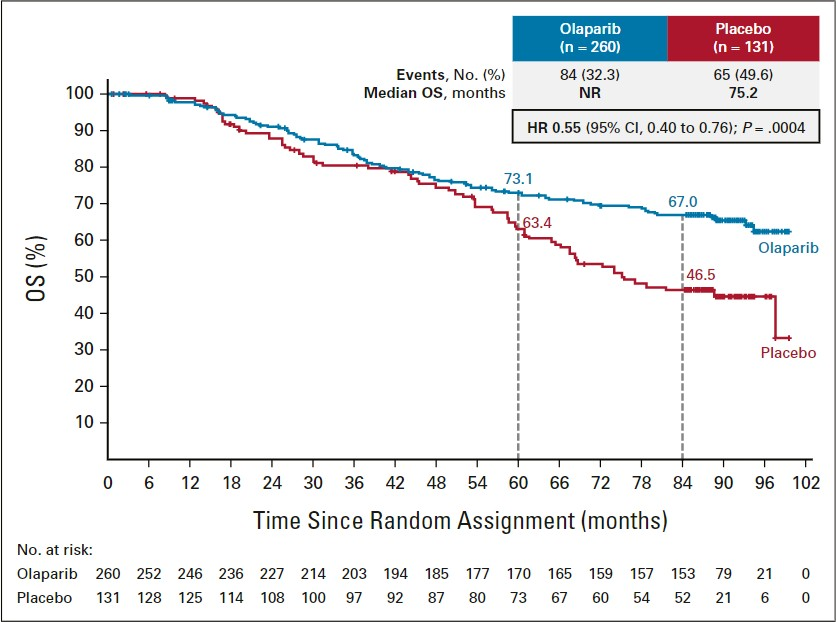
图6:SOLO-1研究7年OS结果[12]
而对于同源重组修复缺陷(HRD)状态,HRD能够导致细胞DNA双链断裂损伤修复缺陷,表现为对引起DNA断裂的铂类药物以及PARP抑制剂高度敏感,因而目前HRD已成为卵巢癌治疗相关的重要生物标志物。
PAOLA-1研究表明,针对一线含铂类药物+贝伐珠单抗治疗有效的卵巢癌患者。HRD(+)患者奥拉帕利联合贝伐珠单抗组患者中位PFS延长19.5个月(37.2个月 vs 17.7个月),复发或死亡风险降低67%。即使在BRCA1/2野生型HRD阳性的患者中,奥拉帕利联合贝伐珠单抗组患者中位PFS也可延长11.5个月(28.1个月 vs 16.6个月),复发或死亡风险降低57%奥拉帕利联合贝伐珠单抗5年OS率提升达 17.1%[13]。
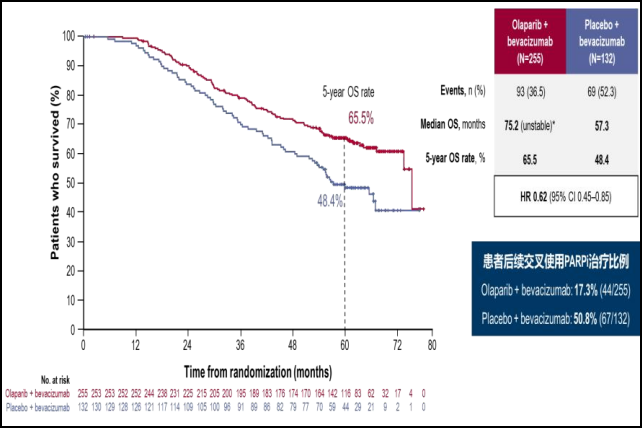
图7:PAOLA-1研究5年OS结果[13]
★
总结
★
对于卵巢癌患者而言,PARP抑制剂及精准治疗策略彻底改变晚期卵巢癌传统治疗格局。依据目前国内、国际权威指南推荐,卵巢癌患者一经确诊,即应进行BRCA或HRD状态检测。同时,卵巢癌肿瘤组织检测将有助于筛选出更多PARP抑制剂获益患者。在一线治疗及维持治疗策略选择方面,贝伐珠单抗无疑能改善新诊断晚期卵巢癌的PFS,增加PARP抑制剂一线和铂敏感复发维持治疗机会。而奥拉帕利为基础的维持治疗,则更加显著的提升了 BRCAm和HRD阳性患者总生存,让临床治愈成为现实。而对于HRD阴性的卵巢癌患者,PARP抑制剂一线维持治疗生存获益有限,从最优全程管理角度出发,根据患者基因检测情况,权衡PARP抑制剂使用时机及维持治疗方案选择应当成为一线维持治疗的准则。